Os metais pesados são elementos químicos com uma densidade superior a 5 g/cm³ e um elevado peso atómico. Devido às suas propriedades físicas e químicas específicas, são utilizados em numerosos processos industriais. Os metais pesados mais comuns nas águas residuais industriais incluem o chumbo (Pb), o cobre (Cu), o zinco (Zn), o níquel (Ni), o crómio (Cr), o cádmio (Cd) e o mercúrio (Hg). No entanto, estes metais são tóxicos mesmo em baixas concentrações e, por conseguinte, representam um desafio considerável para o tratamento da água e das águas residuais.
Índice
Fontes industriais de metais pesados
A utilização industrial de metais pesados leva à sua entrada nas águas residuais. Esta poluição depende em grande medida dos respectivos processos e indústrias. Os metais pesados podem entrar no ambiente através das águas residuais, das águas de lavagem ou dos resíduos de produção. As fontes industriais mais importantes são descritas a seguir:
Eletrodeposição e tratamento de superfície
- Aplicação:
- O níquel, o crómio e o zinco são utilizados na galvanoplastia para revestir metais, a fim de obter proteção contra a corrosão, dureza ou propriedades decorativas.
- Metais pesados nas águas residuais:
- Os contaminantes típicos são o crómio (VI), o níquel, o zinco e o cobre.
- Os desafios:
- A água de enxaguamento contém frequentemente uma combinação de diferentes metais pesados, o que dificulta a separação direcionada.
Processamento de metais
- Produção de aço e alumínio:
- Os resíduos da fundição e do processamento de metais contêm metais pesados como o cádmio, o zinco e o chumbo.
- Fabrico de ferramentas e engenharia mecânica:
- As águas residuais contêm frequentemente contaminação por cobre e níquel proveniente de lubrificantes e líquidos de refrigeração, bem como da tecnologia de produção.
- Indústria automóvel:
- Os metais pesados, como o zinco, o crómio e o cobre, são libertados para as águas residuais durante a produção de veículos, especialmente durante a pintura, o revestimento e o fabrico de componentes.
Exploração mineira e tratamento de minérios
- Aplicação:
- A extração de metais como o cobre, o zinco ou o chumbo e o processamento de minérios produzem águas residuais com elevadas concentrações de ferro, manganês, cádmio e outros metais.
- Os desafios:
- As águas residuais das minas são frequentemente ácidas (a chamada "drenagem ácida das minas") e contêm metais pesados dissolvidos.
Indústria química e petroquímica
- Aplicação:
- Os metais pesados, como o mercúrio, o níquel e o crómio, são utilizados como catalisadores em reacções químicas.
- Metais pesados nas águas residuais:
- Os resíduos dos processos catalíticos e as impurezas das matérias-primas contribuem para a contaminação por metais pesados.
Indústria eletrónica e eléctrica
- Aplicação:
- Os metais pesados como o cobre, o chumbo e o estanho são essenciais para a produção de placas de circuitos impressos, baterias e componentes electrónicos.
- Metais pesados nas águas residuais:
- Os materiais de soldadura, os processos galvânicos e a limpeza dos componentes conduzem à exposição ao chumbo, zinco, níquel e cobre.
Indústria de tintas, vernizes e pigmentos
- Aplicação:
- Os metais pesados, como o crómio, o chumbo e o cádmio, são utilizados como pigmentos de cor e agentes estabilizadores.
- Metais pesados nas águas residuais:
- As águas residuais contêm frequentemente resíduos da produção que são tóxicos e difíceis de biodegradar.
Indústria do vidro e da cerâmica
- Aplicação:
- Metais pesados como o chumbo e o cádmio são utilizados no fabrico de vidros e esmaltes cerâmicos.
- Os desafios:
- As águas residuais contêm frequentemente compostos metálicos que são difíceis de dissolver e requerem um tratamento especial.
Efeitos dos metais pesados no ambiente e na saúde
Toxicidade e bioacumulação
Os metais pesados não são biodegradáveis e acumulam-se no ambiente. Mesmo pequenas quantidades podem causar danos consideráveis aos ecossistemas:
- Crómio(VI): Altamente tóxico e carcinogénico; frequentemente utilizado em processos galvânicos.
- Níquel: Irritante e alergénico; um contaminante comum nas águas residuais industriais.
- Mercúrio: Neurotóxico e extremamente persistente; bioacumula-se nos organismos aquáticos.
- Cádmio: Provoca lesões renais e ósseas; encontra-se frequentemente em pilhas e pigmentos.
Efeitos nos sistemas técnicos
- Corrosão:
- Os metais pesados presentes na água favorecem a corrosão eletroquímica em tubagens e sistemas.
- Perturbação dos processos biológicos:
- Os metais pesados inibem os microrganismos que decompõem as substâncias orgânicas nas estações de tratamento biológico de águas residuais, perturbando assim o desempenho da depuração.
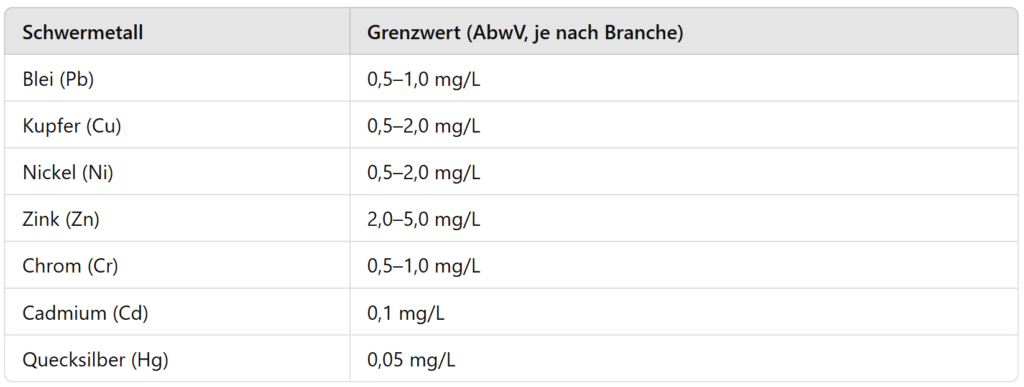
Valores-limite para os metais pesados nas águas residuais industriais
A descarga de metais pesados em massas de água ou em sistemas públicos de águas residuais está estritamente regulamentada. O regulamento alemão relativo às águas residuais (AbwV) estabelece limites específicos para o sector, que devem ser respeitados para minimizar a poluição ambiental.
Processo de remoção de metais pesados da água e das águas residuais
A escolha da tecnologia de tratamento depende da concentração, do tipo de metal pesado e dos requisitos de qualidade da água. Os sistemas CP são frequentemente combinados com permutadores de iões ou filtros de carvão ativado.
1. precipitação e floculação em instalações de PC
A precipitação química é um processo fundamental no tratamento de água e de águas residuais para a remoção de metais pesados. O processo baseia-se na conversão química de iões de metais pesados dissolvidos em compostos pouco solúveis, que podem depois ser removidos da água por sedimentação, flotação ou filtração.
Mecanismo de precipitação
Reação com iões hidróxido (precipitação de hidróxido):
- A adição de álcalis, como o leite de cal (Ca(OH)₂) ou a soda cáustica (NaOH), leva a um aumento do valor do pH, provocando a precipitação de iões de metais pesados sob a forma de hidróxidos metálicos pouco solúveis.
- Isto produz precipitados de hidróxido de metal, que podem ser separados da água devido à sua baixa solubilidade.
Reação com sulfuretos (precipitação de sulfuretos):
- Para os metais pesados com solubilidade particularmente baixa como sulfureto (por exemplo, mercúrio, chumbo), são utilizados iões sulfureto, normalmente a partir de sulfureto de sódio (Na₂S).
- Os sulfuretos têm a vantagem de formar precipitados estáveis mesmo com valores de pH ligeiramente ácidos.
Precipitação com agentes complexantes:
- Nos casos em que os metais pesados estão presentes em complexos estáveis (por exemplo, devido a agentes quelantes como o EDTA), podem ser necessários reagentes especiais para quebrar os complexos antes de se efetuar a precipitação.
Factores que influenciam a precipitação
A eficácia da precipitação depende de vários factores químicos e físicos que devem ser cuidadosamente controlados:
Valor do pH:
- O valor do pH é o parâmetro mais importante, uma vez que a solubilidade da maioria dos hidróxidos de metais pesados depende fortemente do valor do pH.
- Exemplos:
- O hidróxido de zinco precipita de forma óptima a pH 9-10.
- O hidróxido de ferro (III) precipita a um valor de pH de 6-8.
- É necessário um controlo preciso do valor do pH, uma vez que outros metais (por exemplo, o alumínio) podem tornar-se novamente solúveis se o valor do pH for demasiado elevado.
Concentração dos reagentes:
- É necessária uma quantidade suficiente de precipitante para ligar todos os iões de metais pesados. No entanto, a sobredosagem pode levar ao aumento dos custos operacionais e ao consumo adicional de produtos químicos.
Temperatura:
- A velocidade de reação e a solubilidade dos produtos de precipitação dependem da temperatura. As temperaturas mais elevadas favorecem geralmente a velocidade de reação.
Intensidade de agitação e tempo de contacto:
- Uma boa mistura assegura um contacto intensivo entre os reagentes e os iões de metais pesados.
- O tempo de contacto deve ser suficientemente longo para que as reacções químicas se processem completamente.
Interferência de outros iões:
- Os aniões, como o cloreto ou o sulfato, podem aumentar a solubilidade de certos compostos de metais pesados, reduzindo assim a eficiência da precipitação.
- Nestes casos, são necessários reagentes de precipitação adicionais ou passos de pré-tratamento.
Floculação: estabilização e separação dos produtos de precipitação
Após a precipitação, os produtos da precipitação permanecem frequentemente dispersos na água sob a forma de partículas finas. A floculação é utilizada para juntar estas partículas para formar agregados maiores (flocos) que são mais fáceis de assentar ou separar.
Mecanismo de floculação
- Coagulação:
- A adição de coagulantes, tais como sais de ferro (III) ou de alumínio, reduz as forças de repulsão eletrostática entre as partículas, o que facilita a sua aglomeração.
- Floculação:
- Os floculantes, como os polímeros (por exemplo, poliacrilamidas), aumentam a formação de partículas ligando os flocos entre si através da formação de pontes.
Limites de precipitação e floculação
Metais pesados complexados:
- Os metais pesados que estão presentes em complexos orgânicos ou inorgânicos estáveis são difíceis de precipitar. É necessária uma separação prévia dos complexos (por exemplo, por oxidação ou redução).
Concentrações residuais:
- Die chemische Fällung erreicht häufig nicht die extrem niedrigen Restkonzentrationen (< 0,01 mg/l) , die in manchen Industrien erforderlich sind. In solchen Fällen sind ergänzende Verfahren wie Adsorption oder Ionenaustausch erforderlich.
Produção de lamas:
- A precipitação gera grandes quantidades de lamas de precipitação, que devem ser tratadas e eliminadas como resíduos perigosos. Os custos de eliminação podem ser consideráveis.
Crómio(VI):
- Os metais pesados, como o crómio (VI), devem ser reduzidos à forma menos tóxica de crómio (III) antes da precipitação, por exemplo, através da adição de bissulfito de sódio.

Foto: O nosso sistema CP ALMA CHEM MCW com precipitação e floculação, desidratação de lamas e filtro multicamada a jusante e permutador de iões (se necessário)
2. permuta iónica
A permuta i ónica é um processo físico-químico em que os iões dissolvidos na água são substituídos por iões numa resina sólida de permuta iónica. O processo baseia-se na ligação específica de catiões ou aniões a grupos activos num material de resina. Devido à elevada seletividade das resinas, os metais pesados podem ser removidos mesmo de soluções altamente diluídas.
Mecanismo de permuta iónica
- Troca de catiões:
- Os catiões de metais pesados, como Cu²⁺, Zn²⁺ ou Pb²⁺, são substituídos por iões H⁺ (resinas à base de hidrogénio) ou iões Na⁺ (resinas à base de sódio).
- O ião de metal pesado é ligado à matriz de resina e removido da água.
- Permuta aniónica:
- Os complexos de metais pesados com carga negativa, como os cromatos (CrO₄²-), são substituídos por iões OH-.
Tipos de permutadores de iões
Permutadores de catiões fortes:
- Eficaz na remoção de metais pesados como o cobre, o níquel e o zinco de soluções ácidas.
- Pode ser utilizado em valores de pH de 1 a 14.
Permutadores de catiões fracos:
- Eficaz em valores de pH médios a elevados; ideal para soluções ligeiramente ácidas a neutras.
Permutadores de aniões fortes:
- Remover complexos com carga negativa, como cromatos ou arsenatos.
- Utilizar em soluções alcalinas.
Resinas selectivas:
- Desenvolvido para metais pesados específicos, como o mercúrio, o cádmio ou o crómio.
Factores que influenciam a troca iónica
concentração de iões:
- A permuta iónica é particularmente eficiente a baixas concentrações, uma vez que as resinas têm uma elevada afinidade para iões de metais pesados.
Valor do pH:
- Der pH-Wert beeinflusst die Ladung der Schwermetalle und somit ihre Bindung an das Harz. Beispielsweise liegt Eisen bei pH < 3 als Fe³⁺ vor und kann leicht entfernt werden, während es bei höheren pH-Werten zu Hydroxid fällt.
Concurso:
- A presença de outros catiões, como Ca²⁺ ou Mg²⁺, pode reduzir a eficácia da permuta iónica.
Capacidade de resina:
- A carga máxima da resina é limitada pela sua capacidade específica (iões equivalentes por volume).
Regeneração:
- Uma vez atingido o limite de capacidade, a resina é regenerada utilizando produtos químicos como o ácido clorídrico (HCl) ou a soda cáustica (NaOH).
Vantagens e limitações da permuta iónica
Vantagens:
- Seletividade muito elevada, mesmo para baixas concentrações de metais pesados.
- Regenerável, o que reduz os custos de funcionamento.
- Pode ser personalizado para metais específicos (por exemplo, crómio ou cobre).
Limites:
- Capacidade limitada a concentrações elevadas.
- A concorrência de outros iões pode reduzir a eficiência.
- Os produtos químicos de regeneração geram águas residuais adicionais.

Foto: O nosso sistema de permutador de iões ALMA ION com filtro de carvão ativado ALMA FIL AK a montante
3. adsorção por carvão ativado
A adsorção utilizando filtros de carvão ativado baseia-se na adsorção física ou química de iões de metais pesados ou complexos de metais pesados na superfície de um material poroso, como o carvão ativado. A grande superfície interior do carvão ativado é utilizada para fixar as substâncias dissolvidas na água.
Mecanismo de adsorção
- Adsorção física:
- Os metais pesados são retidos na superfície do carvão ativado por forças de van der Waals ou interações electrostáticas.
- Quimisorção:
- Os metais pesados formam ligações químicas com grupos funcionais na superfície do carvão ativado (por exemplo, grupos carboxilo ou hidroxilo).
Tipos de carvão ativado
Carvão ativado em pó (PAH):
- Pó fino que é adicionado diretamente à água.
- Particularmente adequado para tratamentos descontínuos.
Carvão ativado granular (GAK):
- Carvão ativado de grão grosso utilizado em filtros.
- Possibilidade de utilização contínua e a longo prazo.
Carvão ativado impregnado:
- Tratadas com reagentes químicos (por exemplo, enxofre) para remover eficazmente metais pesados específicos, como o mercúrio ou o arsénio.
Factores que influenciam a adsorção
concentração de metais pesados:
- Concentrações mais elevadas conduzem a uma melhor utilização da capacidade de adsorção, mas também a uma saturação mais rápida.
Valor do pH:
- O valor do pH influencia a carga dos iões de metais pesados e a carga superficial do carvão ativado.
- Exemplo:
- Em valores de pH baixos, os metais pesados, como o Pb²⁺, são carregados positivamente e ligam-se bem ao carvão ativado carregado negativamente.
Temperatura:
- Os processos de adsorção são normalmente exotérmicos, pelo que o aumento da temperatura pode reduzir a eficiência.
Estrutura dos poros:
- O tamanho e a distribuição dos poros no carvão ativado influenciam a capacidade de ligação.
Otimização da adsorção
- Pré-tratamento da água:
- A remoção de sólidos em suspensão e de compostos orgânicos melhora a eficácia.
- Utilização de carvão ativado impregnado:
- O carvão ativado especialmente tratado é muito mais eficaz para metais pesados como o arsénio e o mercúrio.
- Regeneração:
- A saturação do carvão ativado pode ser revertida por processos térmicos ou químicos, o que reduz os custos de funcionamento.
Vantagens e limitações da adsorção por carvão ativado
Vantagens:
- Elevada eficiência com baixas concentrações de metais pesados.
- Utilização versátil, também para outros poluentes, como os compostos orgânicos.
- Pode ser impregnado para metais pesados específicos.
Limites:
- Capacidade limitada dos materiais de adsorção.
- A regeneração é intensiva em energia e produtos químicos.
- Menos adequado para concentrações elevadas de metais pesados.

Foto: Os nossos filtros de carvão ativado ALMA FIL AK com filtro multicamada ALMA FIL a montante
Conclusão
O tratamento de águas residuais contaminadas com metais pesados provenientes de processos industriais é um dos principais desafios do tratamento de águas. Os requisitos específicos para o tratamento de águas residuais variam muito consoante a indústria e o processo de produção. Com tecnologias avançadas como a precipitação e floculação em instalações de PC, permuta iónica e adsorção de carbono ativado, os limites legais podem ser cumpridos de forma fiável e o impacto ambiental minimizado.
Para mais informações sobre os nossos produtos, não hesite em contactar-nos a qualquer momento!








