Los metales pesados son elementos químicos con una densidad superior a 5 g/cm³ y un elevado peso atómico. Debido a sus propiedades físicas y químicas específicas, se utilizan en numerosos procesos industriales. Los metales pesados más comunes en las aguas residuales industriales son el plomo (Pb), el cobre (Cu), el zinc (Zn), el níquel (Ni), el cromo (Cr), el cadmio (Cd) y el mercurio (Hg). Sin embargo, estos metales son tóxicos incluso en bajas concentraciones, por lo que suponen un reto considerable para el tratamiento del agua y las aguas residuales.
Índice
Fuentes industriales de metales pesados
La utilización industrial de metales pesados provoca su entrada en las aguas residuales. Esta contaminación depende en gran medida de los respectivos procesos y de la industria. Los metales pesados pueden entrar en el medio ambiente a través de las aguas residuales, el agua de lavado o los residuos de producción. A continuación se describen las fuentes industriales más importantes:
Galvanoplastia y tratamiento de superficies
- Aplicación:
- El níquel, el cromo y el zinc se utilizan en galvanoplastia para recubrir metales con el fin de conseguir protección contra la corrosión, dureza o propiedades decorativas.
- Metales pesados en las aguas residuales:
- Los contaminantes típicos son el cromo (VI), el níquel, el zinc y el cobre.
- Los retos:
- El agua de lavado suele contener una combinación de diferentes metales pesados, lo que dificulta la separación selectiva.
Transformación de metales
- Producción de acero y aluminio:
- Los residuos de la fundición y el tratamiento de metales contienen metales pesados como cadmio, zinc y plomo.
- Fabricación de herramientas e ingeniería mecánica:
- Las aguas residuales suelen contener contaminación por cobre y níquel procedente de lubricantes y refrigerantes, así como de la tecnología de producción.
- Industria del automóvil:
- Metales pesados como el zinc, el cromo y el cobre se liberan en las aguas residuales durante la producción de vehículos, en particular durante la pintura, el revestimiento y la fabricación de componentes.
Minería y tratamiento de minerales
- Aplicación:
- La extracción de metales como el cobre, el zinc o el plomo y el tratamiento de los minerales producen aguas residuales con altas concentraciones de hierro, manganeso, cadmio y otros metales.
- Los retos:
- Las aguas residuales de las minas suelen ser ácidas (el llamado "drenaje ácido de minas") y contienen metales pesados en forma disuelta.
Industria química y petroquímica
- Aplicación:
- Metales pesados como el mercurio, el níquel y el cromo se utilizan como catalizadores en reacciones químicas.
- Metales pesados en las aguas residuales:
- Los residuos de los procesos catalíticos y las impurezas de las materias primas contribuyen a la contaminación por metales pesados.
Industria electrónica y eléctrica
- Aplicación:
- Los metales pesados como el cobre, el plomo y el estaño son esenciales para la producción de placas de circuitos impresos, baterías y componentes electrónicos.
- Metales pesados en las aguas residuales:
- Los materiales de soldadura, los procesos galvánicos y la limpieza de los componentes conducen a la exposición al plomo, zinc, níquel y cobre.
Industria de pinturas, barnices y pigmentos
- Aplicación:
- Metales pesados como el cromo, el plomo y el cadmio se utilizan como pigmentos y agentes estabilizadores.
- Metales pesados en las aguas residuales:
- Las aguas residuales suelen contener residuos de la producción que son tóxicos y difíciles de biodegradar.
Industria del vidrio y la cerámica
- Aplicación:
- En la fabricación de vidrio y esmaltes cerámicos se utilizan metales pesados como el plomo y el cadmio.
- Los retos:
- Las aguas residuales suelen contener compuestos metálicos difíciles de disolver y que requieren un tratamiento especial.
Efectos de los metales pesados en el medio ambiente y la salud
Toxicidad y bioacumulación
Los metales pesados no son biodegradables y se acumulan en el medio ambiente. Incluso en pequeñas cantidades pueden causar daños considerables a los ecosistemas:
- Cromo (VI): Altamente tóxico y cancerígeno; frecuentemente utilizado en procesos galvánicos.
- Níquel: Irritante y alergénico; un contaminante común en las aguas residuales industriales.
- Mercurio: Neurotóxico y extremadamente persistente; se bioacumula en los organismos acuáticos.
- Cadmio: Provoca daños renales y óseos; se encuentra frecuentemente en baterías y pigmentos.
Efectos en los sistemas técnicos
- Corrosión:
- Los metales pesados en el agua favorecen la corrosión electroquímica en tuberías y sistemas.
- Alteración de los procesos biológicos:
- Los metales pesados inhiben los microorganismos que descomponen las sustancias orgánicas en las depuradoras biológicas y, por tanto, alteran el rendimiento de la depuración.
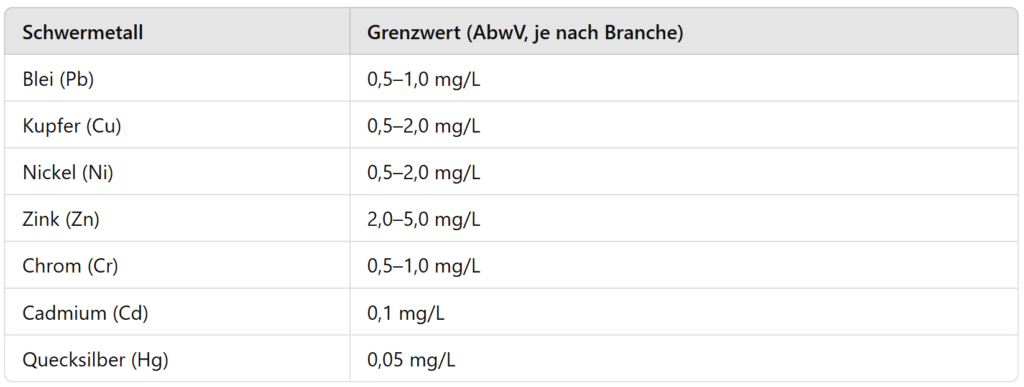
Valores límite de metales pesados en aguas residuales industriales
El vertido de metales pesados en masas de agua o sistemas públicos de aguas residuales está estrictamente regulado. La Ordenanza Alemana de Aguas Residuales (AbwV) establece límites específicos para cada industria que deben respetarse para minimizar la contaminación ambiental.
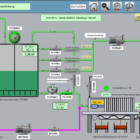
Procedimiento de eliminación de metales pesados del agua y de las aguas residuales
La elección de la tecnología de tratamiento depende de la concentración, el tipo de metal pesado y los requisitos de calidad del agua. Los sistemas CP suelen combinarse con intercambiadores de iones o filtros de carbón activado.
1. precipitación y floculación en plantas CP
La precipitación química es un proceso clave en el tratamiento de aguas y aguas residuales para la eliminación de metales pesados. El proceso se basa en la conversión química de los iones de metales pesados disueltos en compuestos poco solubles, que luego pueden eliminarse del agua por sedimentación, flotación o filtración.
Mecanismo de precipitación
Reacción con iones hidróxido (precipitación de hidróxido):
- La adición de álcalis como la lechada de cal (Ca(OH)₂) o la sosa cáustica (NaOH) provoca un aumento del valor del pH, haciendo que los iones de metales pesados precipiten en forma de hidróxidos metálicos poco solubles.
- Esto produce precipitados de hidróxido metálico, que pueden separarse del agua debido a su baja solubilidad.
Reacción con sulfuros (precipitación de sulfuros):
- Para los metales pesados con una solubilidad particularmente baja como sulfuro (por ejemplo, mercurio, plomo), se utilizan iones sulfuro, normalmente de sulfuro de sodio (Na₂S).
- Los sulfuros tienen la ventaja de que forman precipitados estables incluso con valores de pH ligeramente ácidos.
Precipitación con agentes complejantes:
- En los casos en que los metales pesados están presentes en complejos estables (por ejemplo, debido a agentes quelantes como el EDTA), pueden ser necesarios reactivos especiales para romper los complejos antes de que se produzca la precipitación.
Factores que influyen en las precipitaciones
La eficacia de la precipitación depende de varios factores químicos y físicos que deben controlarse cuidadosamente:
Valor del pH:
- El valor del pH es el parámetro más importante, ya que la solubilidad de la mayoría de los hidróxidos de metales pesados depende en gran medida del valor del pH.
- Ejemplos:
- El hidróxido de zinc precipita óptimamente a pH 9-10.
- El hidróxido de hierro (III) precipita a un valor de pH de 6-8.
- Es necesario un control preciso del valor de pH, ya que otros metales (por ejemplo, el aluminio) pueden volver a ser solubles si el valor de pH es demasiado alto.
Concentración de los reactivos:
- Se necesita una cantidad suficiente de precipitante para ligar todos los iones de metales pesados. Sin embargo, una dosificación excesiva puede provocar un aumento de los costes operativos y un consumo adicional de productos químicos.
Temperatura:
- La velocidad de reacción y la solubilidad de los productos de precipitación dependen de la temperatura. Las temperaturas más altas suelen favorecer la velocidad de reacción.
Intensidad de agitación y tiempo de contacto:
- Una buena mezcla garantiza un contacto intenso entre los reactivos y los iones de metales pesados.
- El tiempo de contacto debe ser lo suficientemente largo para que las reacciones químicas se produzcan por completo.
Interferencia de otros iones:
- Aniones como el cloruro o el sulfato pueden aumentar la solubilidad de ciertos compuestos de metales pesados y reducir así la eficacia de la precipitación.
- En tales casos, se requieren reactivos de precipitación adicionales o pasos de pretratamiento.
Floculación: estabilización y separación de los productos de precipitación
Tras la precipitación, los productos de precipitación producidos suelen permanecer dispersos en el agua en forma de partículas finas. La floculación se utiliza para reunir estas partículas y formar agregados más grandes (flóculos) que son más fáciles de sedimentar o separar.
Mecanismo de floculación
- Coagulación:
- Al añadir coagulantes como sales de hierro (III) o aluminio, se reducen las fuerzas electrostáticas de repulsión entre las partículas, lo que facilita su aglomeración.
- Floculación:
- Los floculantes como los polímeros (por ejemplo, poliacrilamidas) aumentan la formación de partículas al unir los flóculos mediante puentes.
Límites de precipitación y floculación
Metales pesados complejados:
- Los metales pesados presentes en complejos orgánicos o inorgánicos estables son difíciles de precipitar. Es necesario desdoblar previamente los complejos (por ejemplo, por oxidación o reducción).
Concentraciones residuales:
- Die chemische Fällung erreicht häufig nicht die extrem niedrigen Restkonzentrationen (< 0,01 mg/l) , die in manchen Industrien erforderlich sind. In solchen Fällen sind ergänzende Verfahren wie Adsorption oder Ionenaustausch erforderlich.
Producción de lodos:
- La precipitación genera grandes cantidades de lodos de precipitación, que deben tratarse y eliminarse como residuos peligrosos. Los costes de eliminación pueden ser considerables.
Cromo (VI):
- Los metales pesados como el cromo (VI) deben reducirse a la forma menos tóxica cromo (III) antes de la precipitación, por ejemplo añadiendo bisulfito sódico.

Foto: Nuestro sistema CP ALMA CHEM MCW con precipitación y floculación, deshidratación de lodos y filtro multicapa aguas abajo e intercambiador de iones (si es necesario).
2. intercambio iónico
El intercambio iónico es un proceso físico-químico en el que los iones disueltos en el agua se sustituyen por iones en una resina sólida de intercambio iónico. El proceso se basa en la unión específica de cationes o aniones a grupos activos en un material de resina. Debido a la alta selectividad de las resinas, los metales pesados pueden eliminarse incluso de soluciones muy diluidas.
Mecanismo de intercambio iónico
- Intercambio de cationes:
- Los cationes de metales pesados como Cu²⁺, Zn²⁺ o Pb²⁺ se sustituyen por iones H⁺ (resinas a base de hidrógeno) o iones Na⁺ (resinas a base de sodio).
- El ion de metal pesado se une a la matriz de resina y se elimina del agua.
- Intercambio aniónico:
- Los complejos de metales pesados con carga negativa, como los cromatos (CrO₄²-), son sustituidos por iones OH-.
Tipos de intercambiadores de iones
Intercambiadores de cationes fuertes:
- Eficaz en la eliminación de metales pesados como cobre, níquel y zinc de soluciones ácidas.
- Puede utilizarse con valores de pH de 1 a 14.
Intercambiadores de cationes débiles:
- Eficaz en valores de pH medios a altos; ideal para soluciones ligeramente ácidas a neutras.
Intercambiadores de aniones fuertes:
- Eliminar los complejos cargados negativamente, como los cromatos o los arseniatos.
- Uso en soluciones alcalinas.
Resinas selectivas:
- Desarrollado para metales pesados específicos como el mercurio, el cadmio o el cromo.
Factores que influyen en el intercambio iónico
concentración de iones:
- El intercambio iónico es especialmente eficaz a bajas concentraciones, ya que las resinas tienen una gran afinidad por los iones de metales pesados.
Valor del pH:
- Der pH-Wert beeinflusst die Ladung der Schwermetalle und somit ihre Bindung an das Harz. Beispielsweise liegt Eisen bei pH < 3 als Fe³⁺ vor und kann leicht entfernt werden, während es bei höheren pH-Werten zu Hydroxid fällt.
Competición:
- La presencia de otros cationes como Ca²⁺ o Mg²⁺ puede reducir la eficacia del intercambio iónico.
Capacidad de resina:
- La carga máxima de la resina está limitada por su capacidad específica (iones equivalentes por volumen).
Regeneración:
- Una vez alcanzado el límite de capacidad, la resina se regenera utilizando productos químicos como ácido clorhídrico (HCl) o sosa cáustica (NaOH).
Ventajas y limitaciones del intercambio iónico
Ventajas:
- Muy alta selectividad, incluso para bajas concentraciones de metales pesados.
- Regenerable, lo que reduce los costes de explotación.
- Puede personalizarse para metales específicos (por ejemplo, cromo o cobre).
Límites:
- Capacidad limitada a altas concentraciones.
- La competencia de otros iones puede reducir la eficacia.
- Los productos químicos de regeneración generan aguas residuales adicionales.

Foto: Nuestro sistema intercambiador de iones ALMA ION con filtro de carbón activo ALMA FIL AK aguas arriba.
3. adsorción con carbón activado
La adsorción mediante filtros de carbón activado se basa en la adsorción física o química de iones de metales pesados o complejos de metales pesados en la superficie de un material poroso como el carbón activado. La gran superficie interior del carbón activado sirve para aglutinar las sustancias disueltas del agua.
Mecanismo de adsorción
- Adsorción física:
- Los metales pesados se retienen en la superficie del carbón activado mediante fuerzas de van der Waals o interacciones electrostáticas.
- Quimisorción:
- Los metales pesados forman enlaces químicos con grupos funcionales de la superficie del carbón activado (por ejemplo, grupos carboxilo o hidroxilo).
Tipos de carbón activado
Carbón activo en polvo (HAP):
- Polvo fino que se añade directamente al agua.
- Especialmente indicado para tratamientos por lotes.
Carbón activo granulado (GAK):
- Carbón activo de grano grueso utilizado en filtros.
- Posibilidad de uso prolongado y continuo.
Carbón activo impregnado:
- Tratados con reactivos químicos (por ejemplo, azufre) para eliminar eficazmente metales pesados específicos como el mercurio o el arsénico.
Factores que influyen en la adsorción
concentración de metales pesados:
- Las concentraciones más elevadas conducen a un mejor aprovechamiento de la capacidad de adsorción, pero también a una saturación más rápida.
Valor del pH:
- El valor del pH influye en la carga de los iones de metales pesados y en la carga superficial del carbón activado.
- Ejemplo:
- A valores de pH bajos, los metales pesados como el Pb²⁺ tienen carga positiva y se unen bien al carbón activado con carga negativa.
Temperatura:
- Los procesos de adsorción suelen ser exotérmicos, por lo que aumentar la temperatura puede reducir la eficacia.
Estructura de los poros:
- El tamaño y la distribución de los poros del carbón activado influyen en la capacidad de enlace.
Optimización de la adsorción
- Pretratamiento del agua:
- La eliminación de sólidos en suspensión y compuestos orgánicos mejora la eficacia.
- Uso de carbón activado impregnado:
- El carbón activo especialmente tratado es mucho más eficaz para metales pesados como el arsénico y el mercurio.
- Regeneración:
- La saturación del carbón activado puede invertirse mediante procesos térmicos o químicos, lo que reduce los costes de explotación.
Ventajas y limitaciones de la adsorción con carbón activado
Ventajas:
- Alta eficacia con bajas concentraciones de metales pesados.
- Versátil en su uso, también para otros contaminantes como los compuestos orgánicos.
- Puede impregnarse para metales pesados específicos.
Límites:
- Capacidad limitada de los materiales de adsorción.
- La regeneración requiere mucha energía y productos químicos.
- Menos adecuado para altas concentraciones de metales pesados.

Foto: Nuestros filtros de carbón activo ALMA FIL AK con filtro multicapa ALMA FIL aguas arriba
Conclusión
El tratamiento de las aguas residuales contaminadas con metales pesados procedentes de procesos industriales es uno de los retos centrales del tratamiento del agua. Los requisitos específicos para el tratamiento de aguas residuales varían enormemente en función de la industria y el proceso de producción. Con tecnologías avanzadas como la precipitación y floculación en plantas CP, el intercambio iónico y la adsorción con carbón activo, se pueden cumplir los límites legales de forma fiable y minimizar el impacto ambiental.
Si desea más información sobre nuestros productos, no dude en ponerse en contacto con nosotros.