Reductie van zware metalen verwijst naar het proces van het verwijderen of minimaliseren van zware metalen in water- en afvalwatersystemen. Zware metalen zoals koper (Cu), nikkel (Ni), chroom (Cr), zink (Zn), cadmium (Cd) en lood (Pb) zijn een van de grootste uitdagingen in water- en afvalwaterzuivering vanwege hun toxiciteit en persistentie in het milieu. Hun efficiënte reductie is cruciaal om te voldoen aan wettelijke limieten, het milieu te beschermen en de waterkwaliteit voor industriële processen te garanderen.
Inhoudsopgave
Technische achtergrond en kenmerken van zware metalen
Chemische eigenschappen van zware metalen
- Oplosbaarheid:
- Zware metalen kunnen aanwezig zijn als opgeloste ionen, complexen of deeltjes. Hun oplosbaarheid hangt sterk af van de pH-waarde en de chemische omgeving.
- Voorbeeld: chroom(VI) is zeer goed oplosbaar in neutraal tot alkalisch water, terwijl chroom(III) neerslaat als hydroxide.
- Oxidatietoestanden:
- Sommige zware metalen zoals chroom of ijzer komen in verschillende oxidatietoestanden voor, die de keuze van het reductieproces beïnvloeden.
- Complexe vorming:
- Zware metalen kunnen stabiele complexen vormen met organische stoffen (bijv. EDTA), waardoor ze moeilijk te verwijderen zijn.
Uitdagingen in reductie van zware metalen
- Hoge toxiciteit:
- Zware metalen hebben een toxisch effect op aquatische ecosystemen en zijn schadelijk voor de menselijke gezondheid.
- Regelgeving:
- Naleving van wettelijke limieten is vaak alleen mogelijk met complexe processen die uit meerdere fasen bestaan.
- Diversiteit van de samenstelling van afvalwater:
- Industrieel afvalwater kan hoge concentraties zware metalen, organische stoffen en andere verontreinigende stoffen bevatten die een specifieke behandeling vereisen.
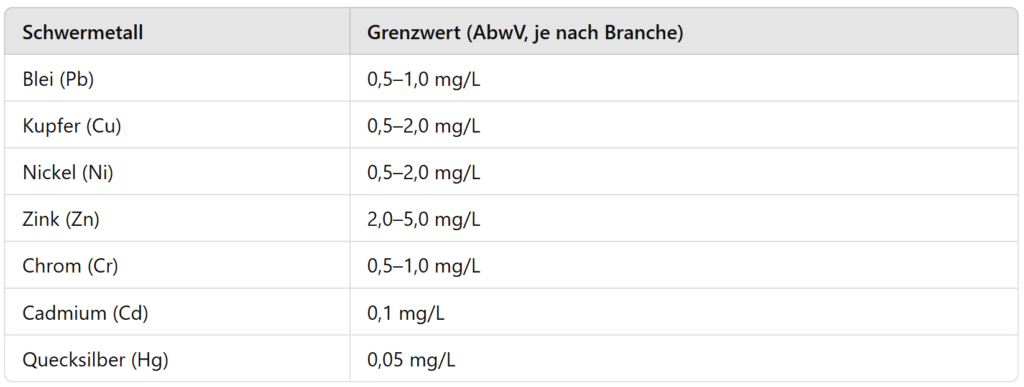
Grenswaarden voor zware metalen in industrieel afvalwater
De lozing van zware metalen in waterlichamen of openbare afvalwatersystemen is streng gereguleerd. De Duitse afvalwaterverordening (AbwV) stelt industriespecifieke grenswaarden vast die moeten worden nageleefd om milieuvervuiling tot een minimum te beperken.
Proces voor het verwijderen van zware metalen uit water en afvalwater
De keuze van de behandelingstechnologie hangt af van de concentratie, het type zwaar metaal en de vereisten voor waterkwaliteit. CP-systemen worden vaak gecombineerd met ionenwisselaars of actieve koolfilters.
1. neerslag en vlokvorming in CP-installaties
Chemische neerslag is een belangrijk proces in water- en afvalwaterbehandeling voor de verwijdering van zware metalen. Het proces is gebaseerd op de chemische omzetting van opgeloste zware metaalionen in slecht oplosbare verbindingen, die vervolgens uit het water kunnen worden verwijderd door bezinking, flotatie of filtratie.
Neerslagmechanisme
Reactie met hydroxide-ionen (neerslag van hydroxide):
- De toevoeging van alkaliën zoals kalkmelk (Ca(OH)₂) of natronloog (NaOH) leidt tot een verhoging van de pH-waarde, waardoor zware metaalionen neerslaan in de vorm van slecht oplosbare metaalhydroxiden.
- Hierbij ontstaan metaalhydroxide neerslagen die door hun lage oplosbaarheid van het water gescheiden kunnen worden.
Reactie met sulfiden (sulfideprecipitatie):
- Voor zware metalen met een bijzonder lage oplosbaarheid als sulfide (bijv. kwik, lood) worden sulfide-ionen gebruikt, meestal van natriumsulfide (Na₂S).
- Sulfiden hebben het voordeel dat ze stabiele precipitaten vormen, zelfs bij licht zure pH-waarden.
Neerslag met complexvormers:
- In gevallen waar zware metalen in stabiele complexen aanwezig zijn (bijvoorbeeld door chelaatvormers zoals EDTA), kunnen speciale reagentia nodig zijn om de complexen af te breken voordat precipitatie plaatsvindt.
Factoren die de neerslag beïnvloeden
De effectiviteit van neerslag is afhankelijk van verschillende chemische en fysische factoren die zorgvuldig gecontroleerd moeten worden:
pH-waarde:
- De pH-waarde is de belangrijkste parameter, omdat de oplosbaarheid van de meeste hydroxiden van zware metalen sterk afhankelijk is van de pH-waarde.
- Voorbeelden:
- Zinkhydroxide slaat optimaal neer bij pH 9-10.
- IJzer(III)hydroxide slaat neer bij een pH-waarde van 6-8.
- Nauwkeurige controle van de pH-waarde is noodzakelijk, omdat andere metalen (bijv. aluminium) weer oplosbaar kunnen worden als de pH-waarde te hoog is.
Concentratie van de reagentia:
- Er is voldoende neerslag nodig om alle zware metaalionen te binden. Overdosering kan echter leiden tot hogere bedrijfskosten en extra chemicaliënverbruik.
Temperatuur:
- De reactiesnelheid en de oplosbaarheid van de neerslagproducten zijn temperatuurafhankelijk. Hogere temperaturen bevorderen over het algemeen de reactiesnelheid.
Roerintensiteit en contacttijd:
- Goed mengen zorgt voor intensief contact tussen de reagentia en de zware metaalionen.
- De contacttijd moet lang genoeg zijn om de chemische reacties volledig te laten plaatsvinden.
Interferentie van andere ionen:
- Anionen zoals chloride of sulfaat kunnen de oplosbaarheid van bepaalde zware metaalverbindingen verhogen en zo de efficiëntie van precipitatie verminderen.
- In dergelijke gevallen zijn extra precipitatiereagentia of voorbehandelingsstappen nodig.
Flocculatie: stabilisatie en scheiding van neerslagproducten
Na precipitatie blijven de neerslagproducten vaak als fijne deeltjes in het water zweven. Flocculatie wordt gebruikt om deze deeltjes samen te brengen tot grotere aggregaten (vlokken), die gemakkelijker te bezinken of te scheiden zijn.
Mechanisme van uitvlokking
- Coagulatie:
- Door coagulanten zoals ijzer(III) of aluminiumzouten toe te voegen, worden de elektrostatische afstotende krachten tussen de deeltjes verminderd, wat hun agglomeratie vergemakkelijkt.
- Flocculatie:
- Vlokmiddelen zoals polymeren (bijv. polyacrylamiden) vergroten de deeltjesvorming door de vlokken aan elkaar te binden door middel van overbrugging.
Grenzen van neerslag en uitvlokking
Gecomplexeerde zware metalen:
- Zware metalen die aanwezig zijn in stabiele organische of anorganische complexen zijn moeilijk te precipiteren. Voorafgaande splitsing van de complexen (bijvoorbeeld door oxidatie of reductie) is noodzakelijk.
Restconcentraties:
- Die chemische Fällung erreicht häufig nicht die extrem niedrigen Restkonzentrationen (< 0,01 mg/l) , die in manchen Industrien erforderlich sind. In solchen Fällen sind ergänzende Verfahren wie Adsorption oder Ionenaustausch erforderlich.
Slibproductie:
- Neerslag genereert grote hoeveelheden neerslagslib, dat moet worden behandeld en afgevoerd als gevaarlijk afval. De verwijderingskosten kunnen aanzienlijk zijn.
Chroom(VI):
- Zware metalen zoals chroom(VI) moeten worden gereduceerd tot de minder giftige vorm chroom(III) voordat ze worden geprecipiteerd, bijvoorbeeld door natriumbisulfiet toe te voegen.

Afbeelding: Ons CP-systeem ALMA CHEM MCW met precipitatie en flocculatie, slibontwatering en stroomafwaarts meerlagenfilter en ionenwisselaar (indien nodig)
2. ionenuitwisseling
Ionenwisseling is een fysisch-chemisch proces waarbij opgeloste ionen in water worden vervangen door ionen in een vaste ionenwisselaarshars. Het proces is gebaseerd op de specifieke binding van kationen of anionen aan actieve groepen in een harsmateriaal. Door de hoge selectiviteit van de harsen kunnen zware metalen zelfs uit sterk verdunde oplossingen worden verwijderd.
Mechanisme van ionenuitwisseling
- Kationenuitwisseling:
- Zware metaalkationen zoals Cu²⁺, Zn²⁺ of Pb²⁺ worden vervangen door H⁺ ionen (harsen op waterstofbasis) of Na⁺ ionen (harsen op natriumbasis).
- Het zware metaalion wordt gebonden aan de harsmatrix en verwijderd uit het water.
- Anionenuitwisseling:
- Negatief geladen zware metaalcomplexen, zoals chromaten (CrO₄²-), worden vervangen door OH-ionen.
Soorten ionenwisselaars
Sterke kationenwisselaars:
- Verwijdert effectief zware metalen zoals koper, nikkel en zink uit zure oplossingen.
- Kan gebruikt worden bij pH-waarden van 1 tot 14.
Zwakke kationenwisselaars:
- Effectief bij gemiddelde tot hoge pH-waarden; ideaal voor licht zure tot neutrale oplossingen.
Sterke anionenwisselaars:
- Verwijder negatief geladen complexen zoals chromaten of arsenaten.
- Gebruik in alkalische oplossingen.
Selectieve harsen:
- Ontwikkeld voor specifieke zware metalen zoals kwik, cadmium of chroom.
Factoren die de ionenuitwisseling beïnvloeden
ionenconcentratie:
- Ionenwisseling is vooral efficiënt bij lage concentraties, omdat de harsen een hoge affiniteit hebben voor zware metaalionen.
pH-waarde:
- Der pH-Wert beeinflusst die Ladung der Schwermetalle und somit ihre Bindung an das Harz. Beispielsweise liegt Eisen bei pH < 3 als Fe³⁺ vor und kann leicht entfernt werden, während es bei höheren pH-Werten zu Hydroxid fällt.
Concurrentie:
- De aanwezigheid van andere kationen zoals Ca²⁺ of Mg²⁺ kan de effectiviteit van de ionenuitwisseling verminderen.
Capaciteit hars:
- De maximale belasting van de hars wordt beperkt door zijn specifieke capaciteit (equivalente ionen per volume).
Regeneratie:
- Als de capaciteitslimiet is bereikt, wordt de hars geregenereerd met chemicaliën zoals zoutzuur (HCl) of natronloog (NaOH).
Voordelen en beperkingen van ionenwisseling
Voordelen:
- Zeer hoge selectiviteit, zelfs voor lage concentraties zware metalen.
- Herwinbaar, wat de bedrijfskosten verlaagt.
- Kan worden aangepast voor specifieke metalen (bijv. chroom of koper).
Grenzen:
- Beperkte capaciteit bij hoge concentraties.
- Concurrentie van andere ionen kan de efficiëntie verminderen.
- Regeneratiechemicaliën genereren extra afvalwater.

Afbeelding: Ons ALMA ION ionenwisselaarsysteem met stroomopwaarts ALMA FIL AK actief koolfilter
3. adsorptie met actieve kool
Adsorptie met behulp van actieve koolfilters is gebaseerd op de fysische of chemische adsorptie van zware metaalionen of zware metaalcomplexen aan het oppervlak van een poreus materiaal zoals actieve kool. Het grote binnenoppervlak van de actieve kool wordt gebruikt om de opgeloste stoffen uit het water te binden.
Mechanisme van adsorptie
- Fysieke adsorptie:
- Zware metalen worden op het oppervlak van de actieve kool vastgehouden door van der Waals krachten of elektrostatische interacties.
- Chemisorptie:
- Zware metalen vormen chemische bindingen met functionele groepen op het oppervlak van de actieve kool (bv. carboxyl- of hydroxylgroepen).
Soorten actieve kool
Actieve kool in poedervorm (PAK):
- Fijn poeder dat direct aan het water wordt toegevoegd.
- Bijzonder geschikt voor batchbehandelingen.
Granulaire actieve kool (GAK):
- Actieve kool met grove korrel gebruikt in filters.
- Langdurig en continu gebruik mogelijk.
Geïmpregneerde actieve kool:
- Behandeld met chemische reagentia (bijv. zwavel) om specifieke zware metalen zoals kwik of arseen efficiënt te verwijderen.
Factoren die adsorptie beïnvloeden
concentratie van zware metalen:
- Hogere concentraties leiden tot een beter gebruik van de adsorptiecapaciteit, maar ook tot een snellere verzadiging.
pH-waarde:
- De pH-waarde beïnvloedt de lading van de zware metaalionen en de oppervlaktelading van de actieve kool.
- Voorbeeld:
- Bij lage pH-waarden zijn zware metalen zoals Pb²⁺ positief geladen en binden ze zich goed aan de negatief geladen actieve kool.
Temperatuur:
- Adsorptieprocessen zijn meestal exotherm, dus het verhogen van de temperatuur kan de efficiëntie verlagen.
Structuur van de poriën:
- De grootte en de verdeling van de poriën in de actieve kool beïnvloeden de bindingscapaciteit.
Optimalisatie van adsorptie
- Voorbehandeling van het water:
- Verwijdering van zwevende deeltjes en organische verbindingen verbetert de effectiviteit.
- Gebruik van geïmpregneerde actieve kool:
- Speciaal behandelde actieve kool is veel effectiever voor zware metalen zoals arsenicum en kwik.
- Regeneratie:
- De verzadiging van de actieve kool kan worden omgekeerd door thermische of chemische processen, wat de werkingskosten verlaagt.
Voordelen en beperkingen van adsorptie met actieve kool
Voordelen:
- Hoog rendement met lage concentraties zware metalen.
- Veelzijdig in gebruik, ook voor andere verontreinigende stoffen zoals organische verbindingen.
- Kan worden geïmpregneerd voor specifieke zware metalen.
Grenzen:
- Beperkte capaciteit van de adsorptiematerialen.
- Regeneratie is energie- en chemie-intensief.
- Minder geschikt voor hoge concentraties zware metalen.

Foto: Onze ALMA FIL AK actieve koolstoffilters met upstream ALMA FIL meerlagenfilter
Uitdagingen in reductie van zware metalen
Restconcentraties:
- Zware metalen moeten vaak worden teruggebracht tot zeer lage concentraties, wat gepaard gaat met stijgende kosten.
- Zielwerte: z. B. Chrom < 0,05 mg/L, Nickel < 0,5 mg/L.
Slibbeheer:
- Processen zoals chemische neerslag genereren grote hoeveelheden slib, waarvan de verwijdering kostenintensief is.
Complexvormer:
- Organische stoffen zoals EDTA of citraten kunnen zware metalen stabiliseren, waardoor ze moeilijker te verwijderen zijn.
Combinatie van technologieën:
- In de praktijk worden vaak verschillende processen gecombineerd, bijvoorbeeld precipitatie en adsorptie, om optimale resultaten te bereiken.
Conclusie
De reductie van zware metalen is een essentieel onderdeel van de behandeling van industrieel water en afvalwater. Afhankelijk van de specifieke vereisten en samenstelling van het afvalwater worden verschillende technologieën gebruikt. Precipitatie en flocculatie in CP-installaties en ionenuitwisseling zijn geschikt voor hoge metaalconcentraties, terwijl adsorptie met behulp van actieve koolfilters domineert bij fijne zuivering. Zorgvuldig procesontwerp en monitoring zijn cruciaal om te voldoen aan de wettelijke vereisten en het milieu op lange termijn te beschermen.
Voor meer informatie over onze producten kunt u altijd contact met ons opnemen!







